近日,365英国上市官网在线靶向藥物遞送團隊在《藥學學報》英文刊Acta Pharmaceutica Sinica B(中科院一區,影響因子14.5)發表題為“Dual-responsive supramolecular photodynamic nanomedicine with activatable immunomodulation for enhanced antitumor therapy”的研究論文,報道了載有光敏劑和斑蝥素的超分子納米粒在乳腺癌治療中的研究與應用。
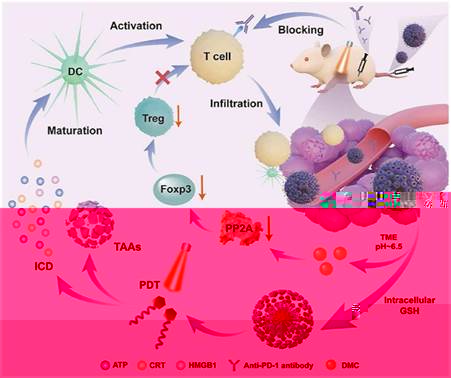
光動力療法(PDT)是治療乳腺癌等淺表腫瘤的一種微創、快速、安全的新興治療方式,能夠誘導免疫性細胞死亡,促進細胞毒性T淋巴細胞在腫瘤微環境(TME)中的浸潤,進一步促進癌症免疫療法。然而,免疫誘導的浸潤性CD8+ T細胞的活性容易受到免疫抑制性TME的影響,尤其是調節性T淋巴細胞(Tregs)的負調控作用,這導緻腫瘤在初次消融後會面臨複發和轉移的風險。基于此,本研究設計了一種基于β- CD的超分子自組裝遞藥系統(DACss),實現免疫抑制性TME的重編程和更強的抗腫瘤效果。通過酸敏感的β-羧酰胺鍵将親水性的DMC修飾在β-CD表面,同時将疏水性的光敏劑二氫卟吩e6與金剛烷相連形成疏水核心Ad-ss-pep-Ce6。兩者可以通過主客分子間的非共價作用結合并形成納米粒。通過EPR效應在腫瘤中被動蓄積後,DMC-CD的β-羧酰胺鍵會在TME的酸性環境條件下水解,局部釋放DMC并抑制Tregs。而剩餘納米粒在進入腫瘤細胞後可響應細胞内高水平的GSH裂解,使得Ce6所在分子結構的疏水性增強,從而增加光敏劑在腫瘤細胞内的滞留。光動力療法與DMC介導的免疫調節相結合,能誘導TME中CTL/Treg比值顯著增加,實現對 TME 的時空調節和重塑,并有效深度推進免疫治療。同時,與PD-1抗體聯用,解決了PDT和DMC引起的腫瘤表面PD-L1上調的副作用,最終提高了抑瘤率并有效抑制肺轉移。
海南大學為本論文的第一單位,四川大學高會樂教授和365英国上市官网在线周泱副研究員為共同通訊作者。研究工作得到了國家自然科學基金等項目支持。
全文鍊接:https://www.sciencedirect.com/science/article/pii/S2211383523004008.
 聯系地址:365英国上市官网在线
聯系地址:365英国上市官网在线 聯系電話/傳真:0898-66254967
聯系電話/傳真:0898-66254967 E-mail:yxyyb@hainanu.edu.cn
E-mail:yxyyb@hainanu.edu.cn
